بافر یا تامپون محلولی است که در مقابل افزایش اسید و باز یا نوسانات غلظت +H مقاومت نشان می دهد. تمامی مولکول های باردار از جمله پروتئین ها مثل آنزیم ها، گیرنده ها، هورمون ها و اسیدهای نوکلئیک در pH 7/4 خون و pH 7/2 داخل سلول دارای بار سطحی مشخص برای اجرای فعالیت خود هستند. هر گونه تغییری در pH خواه افزایش و خواه کاهش باعث تغییر بار سطحی آنها و در نتیجه فعالیت زیستی آنها را تغییر می دهد.
در سیستم های زنده دو نوع سیستم بافری وجود دارد:
1- سیستم بافری خارج سلولی یا پلاسما شامل بیکربنات/اسید کربنیک اسید
2- سیستم بافری داخل سلولی شامل بافر فسفات و اسید آمینه هیستیدین
به طور کلی برای مطالعه ترکیبات بیولوژیکی مثل پروتئینها و آنزیمها و یا اسیدهای نوکلئیک و یا بطور کلی واکنش بیولوژیکی حفظ pH محیط در یک نقطه بهینه از ضروریات می باشد. به همین منظور استفاده از بافرهای بیولوژیکی و درک نحوه عملکرد آن مهم می باشد.
بافرها محلولهايي هستند كه اگر به آنها محلولهاي اسيد و يا قليايي اضافه شود در مقابل تغييرات pH مقاومت ميكنند. به عبارت بهتر بافرها محلولهايي هستند كه از مخلوط كردن يك اسيد ضعيف و يك باز کونژوگه آن و یا یک باز ضعیف و اسید کونژوگه آن بهدست ميآيد. به عنوان مثال از مخلوط كردن اسيداستيك و استات سديم و يا هيدروكسيد آمونيوم و كلرور آمونيوم بافرهاي استات و آمونيوم بهدست ميآيد.
چگونگي مقاومت بافرها در مقابل تغييرات pH به صورت زیر است. اگر روي بافر استات محلول NaOH اضافه شود اين محلول روي استات سديم اثر نداشته بلكه با اسيداستيك تركيب ميگردد و حاصل بجاي يك قليايي قوي مثل NaOH يك قليايي بسيار ضعيف يعني آب خواهد بود. بنابراين تغييرات pH چندان زياد نخواهد بود.
CH3COOH + NaOH ------- CH3COONa + H2O
برعكس اگر روي اين بافر محلول اسيد اضافه شود مثل اسيدكلريدريك، حاصل تركيب اين اسيد كه فقط با استات سديم صورت ميگيرد اسيد ضعيف استيك خواهد بود. در اين صورت ملاحظه ميشود كه تغييرات pH بافر نيز زياد نميباشد.
CH3COONa + HCl --------- CH3COOH + NaCl
بنابراين نتيجه ميشود محلولي كه از تركيب يك اسيد ضعيف با نمك همان اسيد ضعيف بهوجود ميآيد و در مقابل تغييرات pH مقاوم بوده به نام محلول تامپون يا Buffer ناميده ميشود.
ظرفيت تامپوني در نقطهاي كه pH = pKa است ماكزيمم بوده اين نكته از منحني تيتراسيون كاملاً پيدا است زيرا با اضافه كردن باز تغييرات pH در اين نقطه بسيار جزيي است.
در موقع انتخاب یک بافر در کارهای تحقیقاتی بایستی معیارهای متعددی را نظر گرفت. از جمله این موارد می توان به pKa، محدوده بافری، غلظت، و وابستگی آن در اثر تغییر دما. به عنوان مثال بافر تریس که در آزمایشگاه بطور رایج استفاده میشود به تغییرات دمایی حساس است بطوریکه pH آن با افزایش و کاهش دما به ترتیب کاهش و افزایش می یابد.
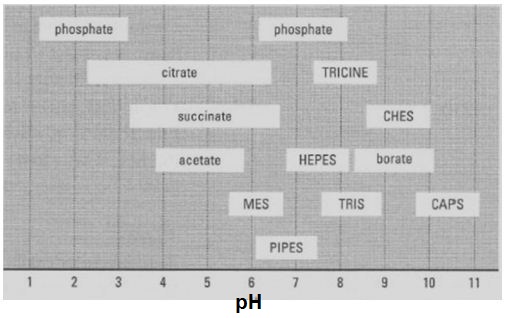
محدوده بافری (Buffer range): محدوده ای از pH است که در آن بافر دارای خاصیت بافری است و آن برابر است با یک واحد pH بیشتر و کمتر از pKa بافری است. به عنوان مثال بافر تریس دارای pKa=8/3 است بنابراین در محدوده pH= 7/3-9/3 دارای خاصیت بافری است و بالاتر یا پایین در از آن pH نمی توان از این بافر استفاده کرد.
در اشکال زیر محدوده بافری و pKa چند بافر رایج آزمایشگاهی را می توانید ملاحظه کنید.

برای دسترسی به متن کامل موارد فوق و اسلایدهای کارگاه آموزشی به فایل های پیوستی رجوع شود.
در صورتی که در انتخاب بافر یا ساخت بافری نیاز به کمک دارید کافی است از طریق ایمیل زیر و یا تلگرام از کارشناسان ما راهنمایی یا کمک بگیرید.Email: این آدرس ایمیل توسط spambots حفاظت می شود. برای دیدن شما نیاز به جاوا اسکریپت دارید